疾患
・クロイツフェルト・ヤコブ病(Creutzfeldt‐Jakob disease, CJD)は100万人に一人の割合で弧発性または家族性に生じ、脳組織の海綿(スポンジ)状変性を特徴とする疾患である。
・CJD は1920 年代初頭、ドイツの神経病理学者Creutzfeldt とJakob によって記述された。現在では成因から、プリオン(prion)病、また病理から伝達性海綿状脳症(transmissible spongiform encephaolopathy, TSE)として哺乳類の神経疾患群にひとくくりにされている。近年、プリオン病またはTSE の感染性がクローズアップされ、社会的に認知された。
プリオン
・Prion とは蛋白質性感染粒子(proteinaceous infectious particle)のことで、TSE の核酸を含まない感染性病原体をさす造語で、米国のPrusiner 博士(1997 年のノーベル賞受賞者)によって1982 年に提唱された。Prusiner 博士は10 年の歳月をかけ、プリオン病の罹患脳から幅4nm 、長さ数百nm程度の感染性の微細線維状物質(エイズの原因ウイルスHIV‐1 は直径100nm で球状)を濃縮していき、プリオン説を唱えるに至った。この微細線維状物質は現在、宿主プリオン蛋白が異常構造体へ変換され、凝集することによって形成されていると考えられている。
ヒトプリオン病
・プリオン病では、異常構造を有する異常プリオン蛋白が中枢神経系に蓄積し、不可逆的な致死性神経障害を生ずる。ヒトプリオン病の大半を占めるのは弧発性 CJDである。
・プリオンには感染性があり、感染性ヒトプリオン病としてクールー(Kuru)、(新)変異型CJD ((new)variant CJD, vCJD)、移植後CJD がある。
・クールーはニューギニアの高地に住むFore 族に年間1%の高率で発症していた疾患である。1966 年にGadjusek らがチンパンジーへの感染実験に成功した。彼らは続いてCJD の感染実験にも成功し、Gadjusek は1976 年にノーベル賞を受賞した。
・1996 年に英国で発表され、ヨーロッパ及び世界中をパニックに陥れたのはvCJD である。これは牛海綿状脳症(bovine spongiform encephalopathy, BSE )に起因していると考えられている。
・一方、プリオン遺伝子に変異を持ち、異常プリオン蓄積の原因となる疾患に遺伝性CJD 、クールー斑状沈着を特徴とするゲルストマン・ストロイスラー・シャインカー症候群(Gerstmann-Str ?ussler-
Scheinker syndrome, GSS)、また致死性家族性不眠症(fatal familial insomnia, FFI)などがある。
疫学
・我が国を含め、世界各国の古典的CJD有病率はほぼ同一で、人口100万人対1前後であり、まれな疾患である。
・発症年齢の平均は62歳であり、女性が男性よりやや多い。
・我が国を含め、世界各国の弧発性CJD 有病率は同一で、人口100 万人対1 前後とまれな疾患である。この様に、地理的に違いがない感染症としてもCJD は特異的である。
・大多数が弧発例で、家族性あるいは遺伝性のGSS が約10% ある。
臨床症状
・弧発性CJD の主症状は進行性認知症とミオクローヌスである。
・発病より数ヶ月で認知症、妄想、失行が急速に進行し、筋硬直、深部腱反射亢進、病的反射陽性などが認められ る。
・さらに起立歩行が不能になり、3 〜7 カ月で無動性無言状態に陥る。1〜2年で全身衰弱、呼吸麻痺、肺炎などで死亡する。
・遺伝性CJD は弧発性CJD に似た臨床症状を示す。GSSは小脳性失調とその後の認知症を特徴とする。
・vCJD は20歳代の若年者に好発し、行動異常、感覚障害、ミオクローヌスを主症状とし、無動性無言状態に陥るのに1年を要する。
病原体
・プリオンは主に、異常プリオン蛋白の凝集による幅4nm 、長さ数百nm 程度の感染性微細線維状物質からなり、その感染価は得られた臓器により一致しないことがあることから、プリオン以外に感染性に影響する因子が想定されている。
・CJDは、経気道、経口感染はないとされるが、大量病原体を経口摂取した場合の発症が疑われている。
・またCJD患者からの移植(角膜、硬膜)、CJD患者由来のヒト下垂体ホルモン投与、病原体に汚染した深部脳波電極を使用した検査により感染したとの報告がある。
・紫外線、エタノール等の消毒法が無効であり、手の汚染、注射針等の刺傷、感染物の眼への飛沫や手で眼をこすることをさける。
・汚染したものは焼却するかSDS (sodium dodecyl sulfate)を3%含む溶液中で100度、5分間以上加熱処理する。臨床材料はBiosafety level 2 (BSL-2)にて扱う。
・プリオン病原体等の臨床材料または剖検材料からの抽出はBSL-2内の安全キャビネットで行う。
病原診断
・異常プリオン蛋白は上記のように蛋白分解酵素に耐性を獲得するので、剖検材料(脳組織、扁桃、脾、髄膜、移植例では角膜)から蛋白分解酵素耐性の異常プ リオン蛋白の同定をウエスタンブロット法やELISA 法によって行う。また、蟻酸処理後に抗プリオン抗体による免疫染色を行う。わが国の食肉衛生検査所では、食肉処理を行う全てのウシの延髄乳剤をサンプルと して、ELISA 法によってスクリーニングを行 い、病理組織および免疫組織化学検査とウエスタン ブロット法によってBSE の確定検査が行われている(2001 年10 月より実施)。実際に感染性を調べる高感度なバイオアッセイとして、正常プリオン蛋白を過剰に発現させたトランスジェニックマウスが開発され、短期間で発 症するので有用である。脾臓には感染後40 日程度で異常プリオン蛋白の集積が認められるので、有効な検索対象であることが判明している。東北大の北本哲之教授によって開発されたマウスプリオン遺伝 子をヒト型へ変更したノックインマウスも、今後活用されていくであろう。他に、尿、血液を使用した検査系の開発も進められている。
検査
髄液検査
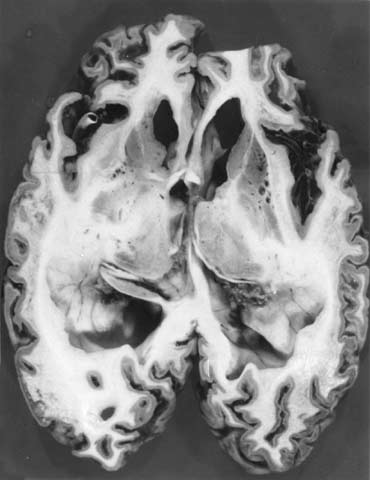
・生前の確定診断法はないが、髄液中の14-3-3蛋白の検出が特にヒトで有効であるという報告が複数ある。画像上CTスキャンでは初期の軽度の大脳皮質の萎縮、脳室拡大がみられ、その後急速な大脳、小脳の萎縮、著明な脳室拡大、白質のびまん性低吸収域が認められる。
脳波
・脳波は初期から基礎律動の不規則性がみられ、その後、「周期性同期性放電(periodic synchronous discharges:PSD )」が出現するのがCJD の特徴である。
画像
・脳CT 画像上では初期に軽度の大脳皮質の萎縮、脳室拡大がみられ、その後急速な大脳、 小脳の萎縮、著明な脳室拡大、白質のびまん性低吸収域が認められる。
・vCJD 例では脳波のPSDはみられず、MRI で視床枕の高電子密度が特異的所見であると報告された。
病理
・病原体の分離には剖検材料(脳組織、扁桃、脾、髄膜、移植例では角膜)から異常プリオン(プロテアーゼ耐性)の同定を免疫組織化学またはウエスタンブロットにより行う。
・PCRによるゲノムの解析は血液等から抽出したゲノムDNAをもとに、プリオン遺伝子のシークエンスを決定し遺伝性を調べる。
・日本人の遺伝性プリオン病(主にGSS)では東北大、北本哲之教授によってコドン102、105、145、219などに変異が発見されている。
・ホルマリン固定後のギ酸不活化パラフィン包埋組織については危険性がなく室温における輸送が可能である。
・3%SDS中で5分間以上煮沸したサンプルに感染性はないので通常のサンプルと同様に保存する。器具等汚染の不活化は極めて困難である。(焼却あるいは3%SDS中で5分間煮沸、5%次亜塩素酸ナトリウム中に2時間以上室温で浸す。高圧蒸気滅菌は132oCで1時間行うが、乾燥した器具等には適さない。)
治療・予防
治・療法は現在開発されておらず、対症療法が主体である。
・栄養の補給、関節拘縮、褥瘡、気道、尿路感染などに注意する。
・最近、クロルプロマジンやキナクリンなどの投与が行われ、一時的に症状の改善が得られたとする報告があるが、治癒するものではなく、今後の研究成果に期待がかかっている。
感染症法における取り扱い (2012年7月更新)
全数報告対象(5類感染症)であり、診断した医師は7日以内に最寄りの保健所に届け出なければならない。
コメント